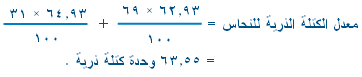|
مرحبـــــــــــــــا بكم في منتديات هشام السالمي منتديات اسلاميه منتديات طبيــــــــــــه تعليم اللغه الانجليزيه تعليم اللغه الفرنسيه تعليم اللغه الفرنسيه منتديات رمضانيه منتديات الكيميـــــــــــــاء والفيزيــــــاء النوويـــــــه منتديات خاصه بـ(غزه)والاراضي المحتله منتديات الثــــــــوره اليمنيــــــــه ورحيل الصالح |


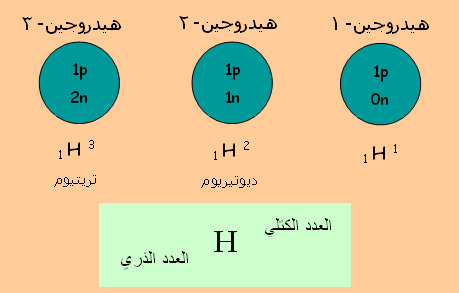
 موضوع: النظائر Isotopes
موضوع: النظائر Isotopes